1) Lo valoramos muy positivamente porque la colaboración de un investigador con su estudiante aporta beneficios a ambos. Por un lado, el estudiante aporta un punto de vista que al científico podría no habérsele ocurrido, y eso haría que la investigación progresase. Hay veces que el científico está tan metido en sus ideas e investigaciones que no se da cuenta de cosas elementales, pero el alumno sí. Casos como estos seguro que han ocurrido muchas veces, donde el "kit" de la cuestión es que dos mentes es mejor que una a la hora de pensar. Pero sin duda, lo más importante de esta colaboración es que el científico ya está creando a otro científico, es decir, la transmisión de los saberes y los pensamientos de un científico experimentado a otro menos experimentado garantiza "la continuidad de la especie", además de que transmiten el interés, la determinación y el amor por la investigación, al estar en contacto directo, y eso, aunque no lo parezca, también es importante.
Hemos investigado sobre varias facultades de Ciencia, y hemos extraído unos párrafos de sus páginas Web que resumen el sistema de enseñanza y la interacción de profesores y alumnos en todas las facultades.
En La Facultad de Ciencias de la Comunicación se hace especial énfasis en preparar a los estudiantes para trabajar individualmente y en equipo, para expresar y defender ideas, informaciones y proyectos, para pensar por sí mismos a partir de una serie de datos comprobables, y para presentar su trabajo, con éxito, en los ámbitos profesionales
La Facultad de Ciencias Sociales se caracteriza por el interés que tienen sus profesores en ayudar a los alumnos a convertirse en grandes profesionales que ayuden a la sociedad a desarrollarse y a crear riqueza. Esta preocupación se demuestra en las horas dedicadas a la preparación de las asignaturas que permiten al alumno a entender y diagnosticar por un lado la problemática social y por otro a darle las soluciones más adecuadas.
Los profesores de la facultad somos profesionales de la docencia con muchos años dedicados a la formación de las personas, que nos exigimos rigor, para convertir el paso por la Universidad en una experiencia única, transmitimos la ilusión de ayudar de manera sistémica al estudiante para que pueda acceder a cargos muy relevantes en las organizaciones que lideran el siglo XXI. Nos caracterizamos porque enseñamos a pensar.
2) La principal diferencia es que los fenómenos físicos no alteran la naturaleza de los elementos sobre los que actuan, los fenómenos químicos al contrario si que alteran la naturaleza de los elementos. La primera frase expone con ironía que la Física es la madre de todas las ciencias, la más importante, hay personas que piensan que las matemáticas son más importantes , pero son simplemenete una herramienta más de la Física. Rutherford se sorprendió cuando le concedieron el Premio Nobel de Química, por eso dijo esa frase, nuestra opinión es que en una parte Rutherford se sintió que el premio de Química tenía menos prestigio que el de Física, y respondiendo a la última cuestión y a esta anterior a la vez coincidimos en que en aquella época las fronteras que definian la Física de la Química eran muy delgadas, debido al desconocimiento, no es como ahora que se distingue perfectamente entre las dos ciencias.
3)
 Su principal aportación fue la teoría de corriente alterna en electricidad, gracias a la cual se pudo idear el primer motor de inducción. él mismo fue el que, basándose en su teoría, construyó el primero en 1887.
Su principal aportación fue la teoría de corriente alterna en electricidad, gracias a la cual se pudo idear el primer motor de inducción. él mismo fue el que, basándose en su teoría, construyó el primero en 1887.También construyó el primer radiotransmisor.
Parte de la enemistad que tenía con los Edison y Marconi (al menos con Edison) no tenían que ver con la ciencia, pero por lo que hemos averiguado, Edison inventó la silla eléctrica que funciona con corriente alterna, la que desarrolló Tesla, en vez de la suya, la corriente continua, para darle mala fama a Tesla. En lo que respecta a Marconi, estuvieron muchos años discdutiendo sobre quién en verdad era el inventor de la radio. Tesla había inventado un dispositivo mucho antes que Bell, y por ello el Tribunal acabó por darle la razón, aunque nunca fue reconocido por la gente y todos siguen pensando que fue Marconi el inventor de la radio.
Laura ha visto la película de El Truco Final, y en ella aparece un invento del propio Tesla que funciona con electricidad. Hay una explicación bastante clara de cómo funciona su sistema de electricidad, aunque lo que consigue, que supuestamente es duplicar objetos y seres, es evidentemente falso.
4)
-La principal diferencia entre ambos fenómenos es que la fluorescencia se da solo mientras esté iluminada y la fosforescencia también se dá despues de haber estado iluminada, otra diferencia es que la fosforescencia se puede encontrar en tierras raras como la willemita y la fluorescencia en la fluorita.
Hemos encontrado un vídeo que diferencia ambos terminos. El uso más común de los rayos X

-Son radiaciones electromagnéticas que son invisbles y que atraviesan cuerpos opacos, este fenómeno es producido por una desaceleración de los electrones.Un señor llamado Wilhelm Conrad observó que cuando hacía pasar una corriente eléctrica por un tubo de vacío se veia el brillo de una pantalla fluorescente. El brillo de la pantalla desaparecía si la corriente era interrumpida. Este hombre atribuyó este efecto a un tipo de radiación que, por ser hasta ese momento desconocida, llamó rayos X.
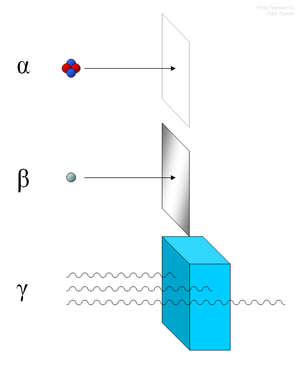 que ganaron el Premio Nobel de Física junto con el francés.
que ganaron el Premio Nobel de Física junto con el francés.














